Actividad física o ejercicio - ¿Cuál es mejor para vivir saludable?
Tabla de contenido:
- ¿Qué es un circuito cerrado híbrido?
- Detalles del producto Minimed 670G
- Disponibilidad y costo
- 'Un momento de la cuenca hidrográfica … Transformando la atención de la diabetes'
- La FDA aprueba Libre Pro
- Descargo de responsabilidad
Guau, ¡qué gran momento para la Comunidad de Diabetes!
El miércoles, la FDA aprobó Medimedic Minimed 670G de Medtronic, el primer "sistema híbrido de circuito cerrado" que puede controlar automáticamente la glucosa y ajustar las dosis basales de insulina en personas de 14 años o más con diabetes tipo 1.

Si bien en la Comunidad de Diabetes nos damos cuenta de que no se trata de un AP de circuito cerrado completo que se hace cargo por completo del control de la diabetes, y Medtronic se está cuidando de referirse a él como un "híbrido", el nuevo Minimed 670G representa un ENORME avance en la automatización de nuestro manejo de enfermedades. ¡Woot!
Aquí está la carta oficial de la FDA a Medtronic sobre esta autorización, así como el comunicado de prensa de la FDA.
Sorprendentemente, esta aprobación regulatoria llega solo 104 días (!) Después de que Medtronic presentó miles de páginas de documentos, lo que es siete meses antes de lo esperado y esta aprobación limita más de una década de investigación, política, y desarrollo de productos para llegar a este hito.
"Esto es fenomenal, ¡y estoy tan emocionado! "Dice Aaron Kowalski, Jefe de Oficiales de la JDRF y por mucho tiempo el tipo 1 mismo. "Es increíble estar en este nivel. Piénselo: esta es la primera vez que uno de estos (sistemas automatizados) ha sido aprobado … y el corto tiempo que le llevó a la FDA aclarar esto. "
Entonces, ¿Qué es este nuevo sistema de control de glucosa y cómo funciona?
¿Qué es un circuito cerrado híbrido?
El término "híbrido" en este caso significa que el sistema está parcialmente automatizado pero aún requiere cierto control por parte del usuario.
La forma en que funciona es que el sensor CGM lee los datos de glucosa cada cinco minutos, y el algoritmo de ciclo cerrado incorporado en la bomba usa esa información para aumentar o disminuir la insulina basal para mantener los niveles de glucosa lo más cerca posible del objetivo. mg / dL. Los usuarios aún necesitan ingresar los conteos de carbohidratos y bolo para las comidas, y alertar al sistema antes de cualquier ejercicio. Tampoco da los bolos correctores automáticos basados en MCG, pero sugiere cantidades de corrección cuando se obtiene un resultado con punción digital. ingresó como lo hacen todas las bombas de insulina estándar a través de la función Bolus Wizard.
< ! --1 ->Esta página de la FDA hace un buen trabajo explicando los detalles. El sistema MiniMed 670G tiene dos modos, uno más "piloto automático" que el otro, pero ambos requieren la intervención del usuario (por lo tanto, no es un circuito cerrado):
Modo manual - en el que el sistema puede ser programado usuario para administrar insulina basal a una tasa constante preprogramada.El sistema suspenderá automáticamente la administración de insulina si el valor de glucosa del sensor cae por debajo o se prevé que caiga por debajo de un umbral predeterminado. El sistema también reanudará automáticamente la administración de insulina una vez que los valores de glucosa del sensor se eleven por encima o se predice que se eleven por encima de un umbral predeterminado.
Modo automático - el sistema puede ajustar automáticamente la insulina basal aumentando, disminuyendo o suspendiendo continuamente la administración de insulina según los valores de CGM (diferente del modo manual en el que la insulina basal se administra a una temperatura constante) tarifa). Aunque el Modo automático puede ajustar automáticamente la administración de insulina basal sin la intervención del usuario, el usuario aún debe administrar insulina manualmente durante las comidas.
Este es un nuevo tipo de dispositivo nunca antes visto en el mercado, y el hecho de que haya sido aprobado aquí en EE. UU. Primero, antes de llegar al mercado europeo e internacional, difícilmente puede ser exagerado.
Detalles del producto Minimed 670G
Exteriormente, el Minimed 670G se ve y se siente casi idéntico al recientemente aprobado Minimed 630G de la compañía que brinda una nueva orientación vertical y pantalla en color al diseño de bomba estándar de Medtronic.

La gran diferencia es que esta bomba de insulina combinada con CGM está controlada por un sofisticado algoritmo que Medtronic llama su tecnología "SmartGuard Hybrid Closed Loop", que puede realizar esos ajustes automáticos a la insulina basal y el apagado automático cuando sea necesario. Los detalles del producto son los siguientes:
- Unidad de bombeo: Como se indicó, el aspecto es el mismo que el Minimed 630G presentado el mes pasado (¿ya está obsoleto?). La misma batería AA, los mismos conjuntos de infusión y el depósito de insulina de 300 unidades, y un poco más grandes que las bombas Minimed de estilo tradicional con su orientación horizontal. A diferencia de las bombas Medtronic más antiguas, este dispositivo solo se ofrece en negro, pero puede comprar una cantidad de máscaras diferentes para realzar el aspecto si lo desea.
- Botones y menús: Las únicas pequeñas diferencias entre el 630G y el nuevo MiniMed 670G son el hecho de que el botón superior derecho lo lleva directamente a los gráficos CGM, frente a la ruta de los menús, y el menú mismo difiere un poco , dadas las nuevas opciones de modo, etc., en el nuevo sistema.
- Pantalla a color: Al igual que el 630G, el nuevo sistema también tiene una pantalla brillante a todo color (!) Que se ajusta automáticamente a las situaciones de iluminación, por lo que por la noche no se iluminará tan intensamente como podría durante el día. Esto parece ser mucho más fácil de leer, un gran beneficio para cualquier persona con impedimentos visuales, por supuesto. Además de los datos básicos de bomba y CGM, Insulin on Board (IOB) se muestra directamente en la pantalla de inicio, algo que los usuarios han estado reclamando.
- CGM Tech: El nuevo sistema utiliza el sensor CGM de cuarta generación con forma de concha de Medtronic, que se conoce como Enlite 3, pero que ahora se conocerá como el sensor Guardian 3 ( tenemos un resumen de todos los diferentes términos de Medtronic en Storify ). La FDA autoriza su uso en el cuerpo durante 7 días, en comparación con los 6 días de las generaciones anteriores.Sin embargo, no hay nada nuevo en el frente adhesivo.

- Precisión mejorada: The Guardian 3 es más confiable y precisa, dice Medtronic, porque usa una nueva señal de radio (introducida con el 630G) para comunicarse entre el transmisor y el sensor. Según los datos clínicos de prueba fundamentales de la empresa en dos calibraciones por día, la tasa de error MARD es, en promedio, 10. 55%, que no es tan buena como la última Dexcom G5 al 9%, pero es mucho mejor que el ~ 14% del el actual Enlite tiene para ofrecer, ¡así que es un potencial cambio de juego al hacer de Medtronic un competidor más fuerte en el mercado de CGM!
- Su modo puede variar: Medtronic dice que escuchó a las personas sobre querer opciones, por lo que permite cambiar de modo: modo automático para la función híbrida de ciclo cerrado, o modo manual que todavía ofrece la función Suspender en baja para cuando cruzas ese umbral de hipo (como el 530G y el 630G tienen ambos), y el Suspend Before Low que se puede configurar para predecir hipos 30 minutos antes de que sucedan (como en el 640G disponible internacionalmente).

- Establecer objetivo BG: Esta tecnología está diseñada para "tratar a destino", lo que significa que funciona para mantener los niveles de glucosa lo más cerca posible de 120 mg / dL. Desafortunadamente, eso no se puede cambiar … lo que significa que Medtronic solo toma la "personalización y personalización" hasta el momento. El usuario puede establecer un objetivo temporal de 150 mg / dL durante hasta 12 horas para hacer frente a situaciones como el ejercicio, pero esa es la única flexibilidad incorporada. Medtronic dice que esto fue el resultado de tratar de llegar al mercado primero, porque permitir diferentes objetivos significan ensayos clínicos mucho más grandes que habrían retrasado la aprobación regulatoria y la comercialización. Las generaciones futuras probablemente permitirán diferentes niveles objetivo, dice Medtronic.
- Sin intercambio de datos: Al igual que el sistema Minimed 630G anterior, este 670G Hybrid Closed Loop no tiene Bluetooth incorporado y no funcionará con Minimed Connect para compartir datos con el teléfono móvil ( ?!). Para aquellos que quieren compartir datos, Medtronic está apuntando a la gente a su sistema Minimed 530G que ahora tiene más de tres años. Como resultado de esta falta de conectividad, el 670G no funcionará con ninguna de las aplicaciones móviles de IBM Watson o que comparten datos en desarrollo.
- Contador de GS conectado: El sistema está configurado para comunicarse directamente con el Bayer Contour Link 2. 4 Metros que Ascensia presentó con el anuncio de lanzamiento 630G. Esto permite el bolusing remoto desde el medidor, pero solo cuando está en modo manual en lugar de hacerlo en el modo automático de circuito cerrado.
- Dos calibraciones diarias: El sistema requiere al menos una calibración con punción digital cada 12 horas, y si no se ingresa, automáticamente expulsa al usuario del Modo automático.
- Serter de una presión: El 670G usa el nuevo Serter de una sola impresión de Medtronic que dice que hará que la inserción del sensor sea más fácil y más cómoda. Requiere solo presionar un solo botón, en comparación con el serter de generación anterior que era más voluminoso y requería dos presiones de botón (una para REPLACEar y otra para retraer).
- Niños y adolescentes: Minimed 670G está oficialmente etiquetado para mayores de 14 años, pero la compañía dice que ya está llevando a cabo pruebas para su aprobación en niños entre 7-13, así como estudios de viabilidad para personas tan jóvenes como 2. La actual carta de aprobación de la FDA establece específicamente que el 670G no debe usarse en menores de 7 años, ni en aquellos que toman menos de 8 unidades de insulina por día (ya que el dispositivo requiere ese mínimo por día para operar con seguridad). Metronic dice que no tiene suficientes datos en aquellos que toman menos de 8 unidades por día para saber si el algoritmo es efectivo y seguro.
Disponibilidad y costo
Con la aprobación regulatoria mucho más rápida de lo esperado, Medtronic nos dice que necesitan al menos seis meses para prepararse para el lanzamiento del producto en EE. UU. A partir de la primavera de 2017. Para los que están fuera de los Estados Unidos, Medtronic dice esperar aprobación regulatoria en algún momento a mediados de 2017.
Hay muchas "partes móviles" que deben estar en su lugar antes del lanzamiento aquí en Estados Unidos, explican, además de que están actualmente en medio del lanzamiento de Minimed 630G; ese modelo anterior recientemente comenzó a enviarse a pacientes en los EE. UU.
Sí, habrá un camino de actualización para cualquiera que use los productos actuales de Medtronic, llamado Programa de acceso prioritario. De hecho, está alentando a los clientes a comenzar con el Minimed 630G en los próximos meses antes de que el 670G llegue al mercado, anunciando que una transición como esa les ayudará a los pacientes a entrenar para la nueva plataforma y reducir potencialmente sus costos de bolsillo a $ 0.
- Costo inicial del programa de acceso prioritario = $ 799
- Crédito de intercambio en la bomba MiniMed 630G y sistema CGM = $ 500
- Costo total de bolsillo del programa = solo $ 299
- Participar en encuestas y otros programas de comentarios de los usuarios puede también reduce ese costo, hasta tan bajo como $ 0 para algunas personas, la compañía declara
El Programa de acceso prioritario se ejecuta hasta el 28 de abril de 2017. Medtronic también dice que más ofertas y posibilidades de actualización pueden revelarse más cerca del tiempo de lanzamiento en la primavera.
Por supuesto, Medtronic también estará trabajando en los próximos meses con pagadores y compañías de seguros en la cobertura de esta tecnología. Con toda la reciente controversia sobre estos temas (#DiabetesAccessMatters), esperamos que Medtronic tenga en cuenta que, si bien muchos pacientes querrán este sistema, puede que no sea la mejor opción para todos, ¡y la elección es importante!
'Un momento de la cuenca hidrográfica … Transformando la atención de la diabetes'
El JDRF emitió un comunicado de prensa el miércoles, expresando su entusiasmo por esta tecnología histórica y la rapidez con que se movió la FDA. La Asociación Estadounidense de Diabetes también intervino con un comunicado de prensa sobre esta aprobación, señalando su importancia.
Piénselo: hace diez años, muchos todavía pensaban que un sistema de bucle cerrado de cualquier tipo era un sueño imposible. Pero JDRF presentó un plan real para avanzar hacia un páncreas artificial. Todavía eran los primeros días de la tecnología CGM … ¡y miren lo lejos que hemos llegado!
"Esto se movió increíblemente rápido y muestra cuán importante fue todo el trabajo duro que hicimos en materia de políticas en el día, para crear una guía para estos sistemas", dijo Kowalski, quien personalmente jugó un papel importante en hacer del desarrollo de tecnología AP una prioridad."Eso cambió todo y creó un camino, y ahora estamos aquí. Es un momento enorme, realmente un momento clave que tiene el potencial de transformar el cuidado de la diabetes".
Si consideramos que el Minimed 670G es un "Páncreas artificial" o no, casi no está al lado … El hecho es que ahora tenemos un dispositivo que está cerrando el ciclo de una manera que no hemos visto antes, constituyendo una generación AP temprana. Es una tecnología potencialmente transformadora que se ha puesto a disposición en un tiempo récord.

De hecho, la FDA otorgó la aprobación del mercado para este Minimed 670G y también requirió estudios adicionales posteriores al mercado para comprender mejor cómo funciona el dispositivo en entornos reales. Eso demuestra que la FDA está dispuesta a analizar los datos existentes y confiar en los beneficios, sin detenerse por la gran cantidad de datos futuros.
El viaje es bastante sorprendente, tal como lo captó en este post D-Mom y la defensora de JDRF desde hace mucho tiempo Moira McCarthy Stanford sobre cómo la organización preparó el camino para este hito y más allá.
También hablamos con Jeffrey Brewer, quien dirige Bigfoot Biomedical, que está desarrollando su propio sistema de circuito cerrado que se espera esté disponible en algún momento de 2018. Junto con Aaron Kowalski, Brewer es considerado uno de los "Padres de la AP" dado su papel en ayudar a desarrollar y promover la vía de circuito cerrado en el JDRF.
"Estamos entusiasmados de que la FDA se esté moviendo más rápido y sea más solidaria con los sistemas automatizados de administración de insulina y esperamos que nos ayuden los mismos vientos". Brewer nos lo dijo.
Sin duda, esto moverá la aguja hacia adelante en los más de otros 18 sistemas de circuito cerrado que están en proceso, especialmente aquellos que solo usan insulina. Algunos agregan la hormona glucagón adicional a la mezcla para combatir la hipoglucemia (como Beta Bionics iLET y Pancreum Genesis), lo que puede requerir más tiempo de evaluación de la FDA.
Nos complace escuchar que nuestros amigos dentro de la comunidad de "hágalo usted mismo" en #OpenAPS también están entusiasmados con esta nueva aprobación y lo que significa para todos nosotros.
Es genial ver que la FDA se mueve tan rápido, no solo con esta aprobación de Minimed 670G, sino también con otros avances emocionantes de tecnología y datos sobre la diabetes en los últimos años. Claramente, la FDA está reconociendo el movimiento #WeAreNotWaiting, y está haciendo todo lo posible para mantenerse al día con estos tiempos de rápido movimiento.
La FDA aprueba Libre Pro
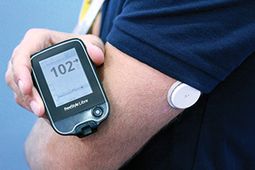
Este no es un dispositivo de consumo, sino la versión clínica de Abbott nueva tecnología Flash Glucose Monitoring (FGM) que ya está disponible para pacientes en el extranjero.
También conocido como un sistema "híbrido", pero solo para la monitorización de la glucosa, Abbott Libre consiste en un pequeño sensor redondo que se usa durante 14 días en la parte posterior del brazo superior, y un controlador que los usuarios simplemente deslizan sobre ella tantas veces al día como sea necesario o deseado para tomar lecturas de glucosa inalámbricas.
No ofrece ninguna alarma para aumentar o disminuir los niveles de glucosa, y la versión para consumidores en el extranjero almacena solo 8 horas de datos.El objetivo es crear una solución de monitoreo más simple que también podría ayudar a muchos tipos 2 a estar más en contacto con sus niveles de glucosa en tiempo real.
Aunque no es un MCG tradicional como el que conocemos, Abbott dice que las reglas regulatorias clasifican a Libre como CGM. Y lo que han aprobado ahora es una versión diseñada específicamente para que los médicos presten a sus pacientes para uso a corto plazo, y solo proporciona datos ocultos para que la vean los médicos. Es un primer paso hacia la versión para el consumidor, que Abbott también ha presentado recientemente para la aprobación de la FDA aquí en los Estados Unidos.
Afortunadamente, eso llegará pronto, con la vía rápida de innovación escalada de la FDA.
¡Un gran agradecimiento a todos los involucrados, no menos a los de la FDA, por el avance de estas importantes herramientas para el cuidado de la diabetes en aras de todos nuestros mejores intereses!
Descargo de responsabilidad : contenido creado por el equipo de Diabetes Mine. Para más detalles, haga clic aquí.Descargo de responsabilidad
Este contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.
NEWS: ¡La FDA aprueba FreeStyle Libre para Estados Unidos!

DiabetesMine comparte las últimas noticias de que el tan esperado sistema Flash Glucose Monitoring de Abbott Diabetes Care finalmente está aprobado en los EE. UU.
Bigfoot compra Asante Snap Tech para sistema de bucle cerrado | DiabetesMine

Una nueva compañía de diabetes llamada Bigfoot Biomedical compró la tecnología de bomba de insulina Asante Snap para desarrollar un páncreas artificial.
Una mirada más profunda a Minimed 670G de Medtronic | DiabetesMine

Wil Dubois completa su prueba de tres meses de la nueva tecnología de diabetes Hybrid Closed Loop de Medtronic, y tiene algunas opiniones contundentes sobre este dispositivo.




