Actividad física o ejercicio - ¿Cuál es mejor para vivir saludable?
Tabla de contenido:
- Dexcom
- Tandem Diabetes
- Insulet y OmniPod
- Diabetes J & J
- BD administración de insulina Tech
- Descargo de responsabilidad
Como hemos señalado anteriormente, una de las mejores maneras de descubrir qué hay de nuevo en la tecnología de la diabetes es seguir las llamadas trimestrales "ear

¿Qué? ¿Dice que no tiene tiempo para unirse a todas estas llamadas del mediodía usted mismo? No se preocupe, ¡lo hacemos por usted!
Sorprendentemente, ya estamos finalizando 2016, y vaya, qué momento tan fascinante de la tecnología es. Los titulares han promocionado noticias recientes sobre el primer sistema comercial de circuito cerrado aprobado por la FDA (páncreas preartificial), que Medtronic planea comenzar a enviar en la primavera de 2017. Naturalmente, ese hito ha dominado la discusión durante gran parte de los últimos meses.
Aquí hay un resumen de lo que aprendimos sobre varios de los principales fabricantes de dispositivos para la diabetes de sus llamadas a resultados recientes:
Dexcom

G5 para Android: Un suplemento de aprobación previa a la comercialización (PMA) para que la aplicación G5 Mobile funcione con teléfonos Android. Esto es muy esperado, ya que la aplicación trabajó con el iPhone desde el lanzamiento del G5 en el verano de 2015. Entendemos que es mucho más complicado obtener la aprobación de Droid, ya que los fabricantes deben obtener la aprobación de la FDA para cada versión del teléfono (en comparación con iOS, que obtiene una manta OK para todos los modelos).
Receptor de próxima generación: Nadie ha visto imágenes o detalles específicos, pero hemos escuchado el rumor de que la próxima actualización del receptor G5 existente incluirá una pantalla táctil. (El receptor actual no ha cambiado mucho desde el modelo G4 original lanzado en 2012). Se dice que la nueva interfaz se parecerá a la aplicación móvil G5, y la FDA continuará requiriendo oficialmente que los pacientes reciban un receptor incluso si lo desean. no lo use y solo téngalo a mano como respaldo para la aplicación del teléfono inteligente.
Nuevo REPLACEador: Este es un nuevo sistema de inserción de botón pulsador en el que Dexcom ha estado trabajando durante un tiempo (¡no más émbolo!). Si bien parece un poco diferente, este sistema parece funcionar de manera similar al REPLACEador de inserción de un botón de Medtronic.
Transmisor más pequeño: Como hemos informado anteriormente, Dexcom también está preparando su transmisor G5 actualizado, que escuchamos será aproximadamente un 50% más pequeño. No hay una palabra oficial sobre si la duración de la batería se extenderá más allá de tres meses, pero es probable que no cambie, ya que es un problema relacionado con el cableado.

Afortunadamente, todo lo anterior llegará más temprano que tarde.
¿Y qué más?
Next-Gen G6: Dexcom también está avanzando en su sensor G6 de próxima generación, que admitirá un desgaste de 10 días y requiere una sola calibración por día, junto con la reducción del ruido de datos y valores atípicos para una mayor precisión. Dexcom ya ha comenzado su prueba fundamental y ha reclutado alrededor del 40-50% del total de 300 adultos y niños que probarán el sistema en una clínica durante tres días, lo que lo convierte en el ensayo fundamental más grande que Dexcom haya realizado alguna vez. Están preparando un posible lanzamiento comercial en 2017. Dexcom dice que planea presentar datos detallados de los estudios pre-pivote en la reunión de la Sociedad de Tecnología de la Diabetes de esta semana en Washington D. C. (¡asistiremos y cubriremos!).

Reclamo de dosificación: Dexcom también continúa trabajando con la FDA en una solicitud de "dosificación" no adjunta para su sistema G5, permitiendo que esta generación de CGM y más allá se etiquete para su uso en lugar de puntas para los dedos. Un panel asesor lo aprobó durante el verano, y ahora la FDA completa está considerando este cambio. Es ampliamente visto como una forma de no solo hacer que CGM esté más disponible para las PCD que deseen usarlo en lugar de las puntas de los dedos, sino también para garantizar una mayor cobertura de CGM para las personas con Medicare. Tal como está, los Centros de Servicios de Medicare y Medicaid (CMS, por sus siglas en inglés) actualmente no cubren CGM, pero esta política sobre la designación de dosificación podría ayudar a persuadir al centro a cambiar su política.
Google Tech: Recuerde también que Dexcom colabora con Verily (anteriormente Google Life Sciences) en la tecnología de diabetes de próxima generación. Lo que nos han dicho es que este será un sensor CGM de tamaño miniatura, ¡tan pequeño como un vendaje o una moneda de diez centavos! El desarrollo de Dr continúa, con un lanzamiento de primera generación planificado para la segunda mitad de 2018 y una segunda generación planificada para aproximadamente 2020.
Hacia un páncreas artificial : Por supuesto, hay toneladas de charla sobre el lanzamiento de sistemas AP comerciales, y el punto de referencia Medtronic Minimed 670G surgió en comentarios preparados y preguntas durante la llamada de Dexcom.
El vicepresidente ejecutivo de Estrategia y Desarrollo Corporativo de Dexcom, Steve Pacelli, señaló cómo se suponía que el lanzamiento de Minimed 530G lanzado en 2013 "devastaría a Dexcom" en base a todo el despliegue de ese producto, pero obviamente eso no sucedió. Así que, por ahora, la compañía dice que hasta que la nueva 670G esté disponible para los pacientes en Spring, no pueden especular sobre cómo podría influir en los negocios de Dexcom.
"Estamos luchando contra un fantasma durante los próximos seis a nueve meses, y realmente no sabremos a lo que nos enfrentamos hasta que tengamos un producto físico", dijo Pacelli en la llamada.
Tandem Diabetes
Sin duda, el t: slim X2 es el producto más informativo que Tandem Diabetes Care tiene en este momento. Aprobado durante el verano, este X2 comenzó a enviarse a mediados de octubre y es la plataforma futura de la compañía de bombas de California que lo hará Permitir a los usuarios actualizar las características desde su hogar, sin necesidad de obtener un dispositivo de hardware diferente cada vez, como se ha requerido tradicionalmente.Está aprobado para mayores de 6 años y ofrece Bluetooth bidireccional para comunicarse con más de un dispositivo externo a la vez.

Integración de Dexcom G5: Durante la llamada de ganancias, el CEO de Tandem, Kim Blickenstaff, dijo que la compañía planea presentar su presentación G5 ante la FDA para fines de año, y con un poco de suerte un período de revisión de seis meses podría traer el lanzamiento a mediados -2017 de un tx de Dexcom habilitado para G5: delgado X2. Esto significaría que si comprara un t: slim X2 ahora, una vez que se apruebe, podrá actualizar la bomba desde su hogar de forma remota para incluir la funcionalidad G5 CGM sin costo adicional.
Presumiblemente, esto también allanaría el camino para una revisión más rápida de la FDA de la próxima generación de la actualización Dexcom G6 en los próximos meses (ver detalles más arriba).
Closed Loop: Tandem también planea en el próximo año avanzar en su sistema de entrega automatizada de insulina (AID), que se basará en los datos del Dexcom G5, que Tandem enfatiza es el sensor más preciso en el mercado . El sistema automatizado de primera generación de Tandem incluirá Suspensión Predictiva Baja de Glucosa (PGLS), lo que significa que la administración de insulina se suspenderá automáticamente cuando se pronostique una hipoglucemia grave, similar a la que ha introducido Medtronic. Tandem terminó su ensayo de factibilidad en agosto y planea llevar a cabo su prueba fundamental a principios de 2017, lo que significa que es probable que se presente una presentación de la FDA a mediados de año, con un posible lanzamiento a fines del próximo año. Eso significa que puede ser solo un puñado de meses más tarde que el previsto lanzamiento de Minimed 670G planificado para Spring, y ofrecería muchas de las mismas características que ese sistema, pero con el Dexcom CGM más popular y el aspecto único de la bomba t: slim ( !)
Se espera que un sistema Tandem de segunda generación que utiliza tanto el algoritmo Dexcom G6 como el de TypeZero Technologies se lance también en algún momento en 2018, dijo Blickenstaff.
A pesar de todo lo que tiene en la tubería, Tandem dice que está viendo un impacto en los pedidos durante esta etapa final del año gracias al Minimed 670G, ya que muchos clientes parecen estar esperando la compra de una nueva bomba hasta que obtengan un un vistazo más de cerca a ese nuevo sistema de "circuito cerrado híbrido". De hecho, hay mucha incertidumbre en este momento, ya que el mercado espera para ver cómo el producto 670G en realidad se realiza una vez lanzado.
Insulet y OmniPod
Mobile Pod de próxima generación: Planee ver esto debutado en las Sesiones científicas de la American Diabetes Association 2017 en San Diego, California. Este nuevo "sistema verdaderamente diferenciado y conectado" será un PDM y una aplicación móvil habilitados para Bluetooth, con capacidades Bluetooth incorporadas en el Pod que contiene insulina. Le dará a los usuarios la capacidad de ver datos clave como IOB (insulina a bordo), último bolus, e incluso datos de Dexcom G5 en la aplicación de teléfono inteligente.
Durante el primer Día del inversionista de Insulet el 16 de noviembre, anunció más detalles sobre esta próxima generación de OmniPod que se denominará la plataforma "DASH" (abreviatura de tablero móvil, al alcance de la mano).

Este será el mismo factor de forma Pod con Blue Tooth Low Energy incorporado, para comunicarse con un nuevo PDM a color con pantalla táctil, cualquier medidor BT habilitado, y permitiendo el intercambio de datos con otros.Sí, eso significa que tendrá que llevar un medidor por separado, diferente de lo que se necesita ahora, con el medidor de glucosa FreeStyle incorporado en el PDM. Para esta plataforma DASH, el Pod tendrá BLE bidireccional y mostrará datos tanto en el PDM como en un teléfono inteligente, por lo que podrá ver información como insulina a bordo, dosificación, BG y datos de CGM. Insulet planea enviarlo a la FDA a mediados de 2017, con un lanzamiento anticipado a fines del próximo año. Esta será la futura plataforma tecnológica de Insulet para usar con el tiempo para las cápsulas U-500 / U-200 que se están desarrollando con Eli Lilly, así como también su tecnología de circuito cerrado de primera generación.
Funcionalidad de circuito cerrado: La primera opción en productos de ciclo cerrado para Insulet será el denominado sistema automatizado de control de glucosa Omnipod Horizon. La compañía mantuvo en secreto gran parte de los detalles de sus planes AP, pero se burla de que esto irá más allá de la Suspensión Predictiva de Glucosa, lo que significa que ofrecerá una funcionalidad más sofisticada que el circuito cerrado híbrido 670G de Medtronic y lo que Tandem dijo públicamente sobre su primer sistema de generación en desarrollo.
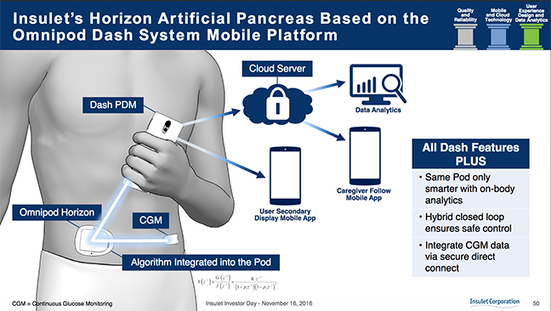
Insulet acaba de completar su primer estudio de investigación sobre el algoritmo en septiembre y pronto comenzará la segunda fase para evaluar cómo funciona para niños y adolescentes. Desafortunadamente, Insulet tiene esto a la vista para un lanzamiento en 2019: dos años completos en los que se espera que otros sistemas lleguen al mercado, colocando a OmniPod significativamente detrás de los competidores en el espacio de circuito cerrado. Conserva el diferenciador único de ser el único sistema con una bomba de parche en este momento, pero aún está lejos en comparación.
Sistema de ciclo cerrado híbrido Horizon planificado para fines de 2018, o en algún momento en 2019.
Para U-500 OmniPod: El trabajo continúa con Eli Lilly en el desarrollo de Humalog U-500 y U-200 (insulina concentrada más alta ) Pods, que permitirían un uso más amplio entre los T2 y otros que necesitan dosis más altas de insulina. Para el Pod U-500 específicamente, Lilly ha terminado la inscripción en el estudio, por lo que la mayor parte de 2017 incluirá ese trabajo de prueba clínica. Insulet proyecta que se trata de una entrada al mercado a finales de 2018 y principios de 2019.
Nueva fabricación: En septiembre, Insulet anunció sus planes de establecer una operación de fabricación automatizada en los EE. UU. Para 2019. Esto tiene como objetivo ayudar a satisfacer la mayor demanda en los próximos años, especialmente a medida que la empresa del área de Boston lanza un nuevo producto plataformas y, finalmente, su sistema de circuito cerrado en los próximos años.
Diabetes J & J
Vibrador Animas de próxima generación con Dexcom G5: La reciente convocatoria de inversionistas Johnson & Johnson Diabetes no mencionó específicamente su marca de bombas Animas específicamente, pero sabemos que su bomba de segunda generación combinada CGM , el Animas Vibe habilitado para G5, se encuentra actualmente bajo revisión de la FDA después de haber sido presentado el 4 de junio de 2016.
Nadie habla específicamente sobre el diseño o la aplicación móvil planea su nuevo Vibe, pero cuando se apruebe, sin duda será un impulso de biz para Animas y Dexcom. Por supuesto, estamos cruzando los dedos para una aprobación más pronto que más tarde, pero no se superponen demasiado con el tan esperado lanzamiento de Dexcom G6.
BD administración de insulina Tech
Durante su Analyst Day el 17 de noviembre, Becton Dickenson anunció dos nuevas innovaciones que tiene en las obras:
Bomba de parches para el Tipo 2: Una nueva bomba de parches de tipo 2 que será completamente desechable, con tres días de uso, con dosificación basal y en bolo. Pocos detalles están disponibles, como de la compañía rápida para limitar las especificaciones del producto por razones de "confidencialidad", pero espera a ver esto en algún momento en el año fiscal 2017.


Smart aguja para pluma Tecnología: Este será compatible con Bluetooth y Permitir que los datos de dosificación se compartan, ya que BD trabaja para llevar más administración de diabetes interconectada a su cartera de productos. Estas agujas de pluma en desarrollo funcionarán con todo tipo de plumas de insulina, dice BD.

Estos son solo algunos fragmentos de las muchas cosas emocionantes que están sucediendo en el progreso de D-Tech: ¡todo bien!
¿Qué piensan ustedes?
Descargo de responsabilidad : contenido creado por el equipo de Diabetes Mine. Para más detalles, haga clic aquí.Descargo de responsabilidad
Este contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.
Diabetes Actualizaciones de tecnología e industria a mediados de 2016

DiabetesMine informa sobre la tecnología de diabetes de próxima generación proveniente de compañías como Dexcom, Insulet, Tandem Diabetes, y MannKind Corp.
ADA 2012: actualizaciones de Diabetes Company de la planta de la Expo

ADA 2012: actualizaciones de la empresa Diabetes de la planta de la Expo
Diabetes Cure Talk: Actualizaciones de investigación de ADA 2016

DiabetesMine revisa las últimas actualizaciones sobre la investigación sobre curación después de las sesiones científicas de la Asociación Americana de la Diabetes en junio 2016.



