Actividad física o ejercicio - ¿Cuál es mejor para vivir saludable?
Grandes noticias, D-Friends: ¡la nueva insulina inhalable de acción rápida conocida como Afrezza acaba de obtener la aprobación de la FDA!
La tercera vez es el encanto de esta nueva formulación de insulina inhalable, la segunda en pasar por el proceso regulatorio de EE. UU. Después de la exuberación fallida de Pfizer la mayor parte de una década atrás.
El viernes, la compañía de biotecnología de California, MannKind Corp., finalmente obtuvo la aprobación regulatoria para su dispositivo Afrezza.

Ahora, después de volver a presentar Afrezza en octubre de 2013, MannKind finalmente ha convencido a la FDA de que está listo para ponerse en manos de adultos con diabetes.
Los principales ejecutivos de MannKind nos dicen que están trabajando para encontrar un socio farmacéutico que fabrique y distribuya Afrezza, y que el producto podría estar disponible tan pronto como en enero o al final del primer trimestre de 2015. > En el comunicado de prensa de la FDA emitido el viernes, el Dr. Jean-Marc Guettier de la División de Metabolismo y Productos de Endocrinología de la agencia afirma: "La aprobación de hoy amplía las opciones disponibles para administrar insulina durante la comida en el manejo general de pacientes con diabetes que lo requieren para controlar los niveles de azúcar en la sangre. "
Afrezza es una insulina de acción ultrarrápida en polvo que está diseñada como insulina precomida para adultos (aún no para niños) ) con diabetes tipo 1 o tipo 2. Está dirigido a los picos de azúcar en la sangre después de las comidas, lo que significa que se usa con el tratamiento con insulina existente y no pretende ser un tratamiento de insulina independiente.
La insulina en polvo se administra a través de un inhalador del tamaño de un silbato llamado Dreamboat, que se desarrolló después de la primera ronda de la FDA y causó retrasos porque la agencia quería más estudios clínicos con ese nuevo inhalador. El polvo se disuelve inmediatamente cuando se inhala en los pulmones, y la insulina se vierte rápidamente en el torrente sanguíneo para comenzar a funcionar. Afrezza alcanza su punto máximo en 12 a 15 minutos y está fuera del sistema en una hora, en comparación con las insulinas actuales de corto plazo que generalmente tardan al menos 20 minutos en activarse, alcanzan un máximo de 2-3 horas y pueden permanecer en el sistema por tan largo como cinco horas
Por supuesto, el mayor atractivo es que no requiere agujas, sino solo un pequeño inhalador de mano que realmente parece un silbato.El Dreamboat está destinado a ser desechado después de 15 días para evitar la acumulación de polvo en el interior que podría obstruir el dispositivo. A diferencia de la insulina tradicional, no necesita refrigeración, sino que se mantiene a temperatura ambiente. Cada cartucho de un solo uso contendría 4 u 8 unidades, y para cuando se comercialice Afrezza, podría haber un cartucho de 12 unidades disponible.
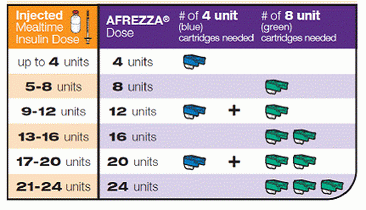
A continuación, le indicamos cómo puede administrar la dosis, convirtiendo la inyección de insulina actual o las cantidades en bolo en una dosis inhalable compatible con Afrezza:
Personalmente, eso no parece mucha insulina para cubrir algunas de las comidas que como requieren dosis más altas … estaría revisando un montón de esos pequeños cartuchos. Entonces, para algunas PCD, ¿este dispositivo puede presentar un desafío logístico en términos de dosificar fácilmente las cantidades que necesitamos …? Pero, una vez más, esta puede ser una buena herramienta para eliminar azúcares elevados en la sangre con dosificación correctiva.
En una conversación telefónica el viernes por la noche, el presidente de MannKind, Hakan Edstrom, nos dijo que la compañía aún no ha finalizado ningún trato con socios potenciales para poder fabricar y distribuir Afrezza. Pero se está acercando, y en conversaciones con varias compañías para finalizar una sociedad tan pronto como sea posible.
Los costos siguen siendo determinados (mucho depende de la asociación potencial), pero Edstrom dice que esperan que los precios estén en el mismo rango que los pacientes que normalmente pagamos ahora por los lápices de insulina en los EE. UU.Esta aprobación es un ENORME desarrollo, y ha tardado en llegar, ocho años desde que comenzó esta búsqueda por Alfred Mann, el hombre que fundó Minimed antes de que finalmente fuera comprada por Medtronic. Hemos estado siguiendo la historia de Afrezza durante años aquí en la '
Mine - desde los días iniciales de presentación de la FDA cuando MannKind tuvo su diseño inicial de clunky, hasta la cobertura más reciente sobre cómo se usa Afrezza en el páncreas artificial ensayos clínicos.
Antes del nuevo envío de la FDA en otoño pasado, escuchamos a MannKind jactarse de sus estudios clínicos de Fase III el verano pasado que incluyeron más de 500 DWP tipo 1 en los EE. UU. Y en todo el mundo, lo que indicó que la compañía estaba lista para intentar nuevamente con la FDA.
El comité asesor que se reunió el 1 de abril de este año votó 13 a 1 que Afrezza era lo suficientemente seguro y eficaz para su aprobación como tratamiento para la diabetes tipo 1, con el único disidente David Cooke votando que los riesgos superan los beneficios para el tipo 1s.Señaló la revisión interna de la FDA que mostró que algunos pacientes que tomaron Afrezza interrumpieron el tratamiento después de desarrollar espasmos bronquiales, tos y una disminución en el funcionamiento de sus pulmones. Pero ninguna de esas preocupaciones surgió durante la votación sobre Afrezza para uso de tipo 2, y el comité decidió por unanimidad a favor con un voto de 14-0.

No se recomienda para personas con diabetes que fuman, ni para tratar la cetoacidosis diabética (DKA).
Afrezza solo está aprobado para adultos, no para niños. Sin embargo, la agencia está solicitando un ensayo clínico posterior al mercado para evaluar la seguridad y el uso en pacientes pediátricos.
- La FDA está requiriendo una Advertencia en caja, informando que algunas personas con asma y enfermedad pulmonar obstructiva crónica (EPOC) que han usado Afrezza han experimentado broncoespasmo agudo. Como resultado, aquellos con enfermedad pulmonar crónica, asma o EPOC, no deben usar Afrezza debido a este riesgo. Las reacciones adversas más comunes asociadas con Afrezza en ensayos clínicos fueron hipoglucemia, tos y dolor o irritación de garganta.
- Parte de los requisitos de aprobación son una Estrategia de evaluación y mitigación de riesgos, que debe incluir un plan de comunicación para informar a los profesionales de la salud sobre el grave riesgo de broncoespasmo agudo asociado a Afrezza. Eso significa asegurar que los beneficios superen los riesgos potenciales del uso de Afrezza.
- Se requieren otros estudios post-mercado en Afrezza, como: ensayo clínico para evaluar el riesgo potencial de malignidad pulmonar con el uso (este ensayo también evaluará el riesgo cardiovascular y el efecto a largo plazo de Afrezza en la función pulmonar); y dos ensayos clínicos farmacocinéticos-farmacodinámicos con glucosa euglucémica con clamp, uno para caracterizar la dosis-respuesta y otro para caracterizar la variabilidad dentro del sujeto.
- Edstrom nos dijo que planean iniciar los ensayos pediátricos lo antes posible, lo que realmente comenzará a mediados de 2015. Eso significa que Afrezza podría no estar aprobado para niños con diabetes hasta 2017, y ese proceso regulatorio puede variar según lo que demuestren los estudios posteriores al mercado y la experiencia de uso de adultos.
- Y a pesar de la luz verde de la FDA, no hay garantía de que Afrezza tenga éxito comercial o de que las PCD se junten para usarlo. Como se señaló, MannKind aún no ha asegurado ningún socio farmacéutico listo para vender Afrezza. Pero si la convocatoria de ganancias de MannKind en mayo es una indicación de lo que vendrá pronto, una asociación potencial puede no estar lejos.
Desde el punto de vista de los inversores, muchos son escépticos en base a la insulina inhalada Exubera fallida que ha formado gran parte de la discusión sobre Afrezza en los últimos años. Ese producto conjunto de Pfizer-Sanofi fue retirado del mercado en 2007 después de más de un año de ventas mediocres, lo que resultó en un récord de $ 2. 8 mil millones de pérdidas para los vendedores.
Por supuesto, MannKind afirma que Afrezza es significativamente diferente, principalmente porque Exubera usó un inhalador grueso de un pie de largo y se relacionó con un mayor riesgo de cáncer de pulmón que Pfizer simplemente no pudo superar.
Veremos qué piensa D-Community ahora con Afrezza, especialmente con toda la atención de ensayos clínicos de AP que ha tenido más recientemente. Ya sea que eso sea suficiente para convencer a las masas aún no está claro …
Inhale las noticias por el momento, y veremos cuánto tardan todos en exhalar y convertir esta emoción en ventas reales y uso generalizado.
Descargo de responsabilidad
: contenido creado por el equipo de Diabetes Mine. Para más detalles, haga clic aquí.
Descargo de responsabilidad Este contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.Deteniendo nuestra respiración por la insulina inhalada Afrezza

DiabetesMine analiza cómo está llegando al mercado el nuevo producto Afrezza Inhaled Insulin, y esto significa para el futuro del manejo de la diabetes.
Insulina Afrezza inhalada recibió aprobación de la FDA

La FDA aprobó un nuevo producto de insulina inhalada. Afrezza es una insulina de acción ultrarrápida en forma de polvo, diseñada como una comida previa para los diabéticos tipo 1.
Test Impulsando la nueva insulina inhalada Afrezza | DiabetesMine

Una revisión de la nueva insulina inhalada Afrezza de Sanofi y MannKind, que produce excelentes resultados de azúcar en la sangre muy rápidamente.

