Ejercicio fisico-Cuidado del cuerpo
En el mundo de los dispositivos para la diabetes, ejecutivos de la compañía Los profesionales de relaciones públicas, los representantes de ventas e incluso los médicos suelen ser imprecisos sobre cuándo aparecerán nuevos productos en el mercado y si estarán disponibles para nosotros, las personas con diabetes. Tout nuevas herramientas "próximamente" sin ninguna especificidad sobre cuándo un producto podría estar realmente disponible. Y en los foros de mensajes frecuentados por pacientes, los rumores pueden volar.

Después de un año emocionante de nuevas aprobaciones de productos para la diabetes en 2012, queríamos saber más sobre el estado de estos desarrollos y dónde están los proveedores en términos de poner estos nuevos productos D en nuestras manos. .
Todos sabemos que a veces mirar introducciones de dispositivos de diabetes en el extranjero es como mirar en una bola de cristal para lo que vendrá en Estados Unidos, pero todavía es difícil establecer una línea de tiempo específica para su aparición en los Estados Unidos
Compañero D-Blogger Michael Aviad más recientemente en ASweetLife recientemente compiló una lista de siete nuevos D-productos esperados en algún momento de este año. Con el tiempo en marcha ahora que el 2013 ha comenzado, pensamos que valía la pena investigar exactamente cuando algunos de estos y otros productos nuevos se espera que lleguen al mercado de manera realista.
Así que aquí está nuestro control de realidad minuto a minuto sobre qué esperar en 2013 (o al menos "palabra" de los propios vendedores):
Abbott FreeStyle Navigator II
Recuerde el ahora difunto sistema FreeStyle Navigator CGM (monitoreo continuo de glucosa) que Abbott suspendió en los EE. UU. En agosto de 2011 (después de que nos condujeran a un ¿Cuánto tiempo estuvo "suspendido" un poco? Bueno, nos enteramos después de la conferencia EASD (Asociación Europea para el Estudio de la Diabetes) en octubre que Abbott estaba explorando un lanzamiento silencioso de su Navigator de próxima generación para los Estados Unidos. En ese momento, el director de asuntos públicos de la compañía no nos contó ninguna presentación formal fue hecho en EASD, y que no sucedía nada con respecto a un lanzamiento en los Estados Unidos.
Pero nos mantuvimos curiosos. Especialmente después de conocer un ensayo clínico aprobado por la FDA aquí en Santa Fe, NM y Atlanta, GA, que involucra al Navigator II. Y después de ver fotos y detalles aparecen en línea en el sitio web alemán de la compañía.

Al comienzo de este nuevo año, nos pusimos en contacto con el director de relaciones públicas, Jeff Christensen, y él nos dijo:
"Como sabe, el sistema FreeStyle Navigator original se suspendió en EE. UU. Ese estado continúa sin cambios. a FreeStyle Navigator II, no solemos revelar estrategias comerciales específicas o nuestros planes para presentaciones regulatorias. Sin embargo, puedo confirmar que continuamos desarrollando nuestra próxima generación de productos basados en la tecnología de detección en el corazón de FreeStyle Navigator … < "El estudio específico al que hizo referencia involucró a 31 inscritos y se completó, como se indica en la entrada de ClinicalTrials.gov. La información que tenemos disponible sobre ese estudio es lo que se publica (allí). "
Claro, lo conseguimos, hay cosas que simplemente no se pueden decir. Pero para una compañía que le quitó la alfombra a tantos leales clientes con la falta de disponibilidad original de Navigator, esperamos un poco más. Personalmente, es difícil ver cómo alguien podría mirar más allá del comportamiento pasado de Abbott y registrarse en la compañía en el futuro … pero, quién sabe. todo depende del dispositivo, al parecer.
A partir de ahora, Christensen dice que el Nav II está disponible en Bélgica, Dinamarca, Francia, Alemania, Israel, los Países Bajos, Noruega, Suecia y el Reino Unido. Por lo tanto, tendremos que esperar y ver si llega a Estados Unidos.Sistema Integrado de Bomba y CGM de Animas
Todos han estado esperando la próxima bomba integrada y CGM, y la que parece estar en el horizonte en el futuro cercano es Animas Vibe (que obtuvo la aprobación europea en el verano de 2011). Con la aprobación emocionante del año pasado de la Dexcom G4 Platinum CGM, la pieza final para el Vibe parecía haber caído en su lugar. Los funcionarios de la compañía dijeron que habían estado esperando la aprobación del G4 para poder enviar el Vibe actualizado a la FDA para su aprobación.
"
Llevar Animas Vibe al EE. UU. Y Canadá es una de nuestras principales prioridades. Nos comprometemos a enviar el PMA (solicitud de aprobación previa al mercado) para el sistema de gestión de glucosa Animas Vibe tan pronto como sea posible en 2013.
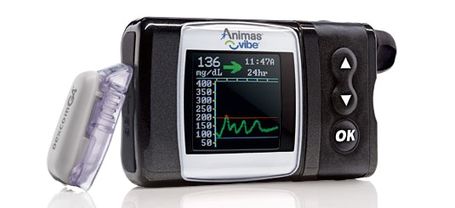
Sin embargo, la compañía tenía más que decir sobre un reloj diferente. En diciembre, Animas envió una carta a los clientes sobre un problema técnico con sus modelos anteriores de bomba de insulina 2020 (los anteriores al Ping). Básicamente, el software en esas bombas tiene una falla que significa que la bomba 2020 ya no entregará insulina después de la medianoche del 31 de diciembre de 2015 (!)
Se materializará una "alarma de servicio de llamada". Entonces, unos tres años antes de que se manifieste este problema por una bomba que recientemente se suspendió en los EE. UU. Y Canadá, Animas alerta a todos, con la nota de que la etiqueta del producto se actualizará para reflejar este problema. Nada afectará las operaciones de la bomba antes de 2016, por lo que las bombas ya no necesitan hacer nada, y antes se cumplen las garantías de reemplazo para una bomba gratis.
Lástima que el mismo tipo de comunicación proactiva no se esté aplicando al Animas Vibe y la presentación de documentación, que "probablemente" esté sucediendo en la primera mitad de este año, según nos cuentan.
Asante Pearl Pump
Poco ha pasado con Asante Solutions, con sede en Sunnyvale, California, desde que recibió la aprobación de la FDA para una nueva bomba de insulina parcialmente desechable en mayo de 2011. Se esperaba que el Asante Pearl estuviera bien en el mercado. , pero eso no ha llegado a ser. Vimos a Asante en una presentación durante las sesiones científicas de la ADA en junio, y también han contratado nuevos ejecutivos a lo largo de 2012.Pero no ha habido mucho más de ellos …
Cuando se le preguntó, el portavoz de la compañía Steve Bubrick nos dice que Asante espera que Pearl Pump se lance a pequeña escala a mediados de 2013, adoptando un enfoque regional en vez de nacional. "haz la receta correcta". Han estado acumulando inventario y preparándose para el inminente lanzamiento, dice.

Sensible porque no tienes que llenar un depósito como con bombas tradicionales. En su lugar, utiliza un cartucho precargado de 300 unidades que cabe en una ranura de eliminación en la parte posterior de la bomba (la cosa negra en la foto). Esta porción se une y se separa al "cerebro" no desechable de la bomba (controlador con botones y pantalla) que se parece a muchos otros. Cada siete días, extrae la porción del cartucho y la tira antes de conectar una nueva. La bomba utiliza un conjunto de infusión patentado con tecnología de oclusión incorporada que, como cualquier otro conjunto en el mercado, debe cambiarse cada 2 o 3 días. Por ahora, Pearl solo toma un cartucho de Humalog, pero Bubrick dice que esperan expandirse a otras insulinas como Novolog en el futuro cercano.
OmniPod de Next-Gen del Insulet
Es difícil que haya
verado las noticias de mediados de diciembre sobre el OmniPod de nueva generación que obtuvo la aprobación de la FDA. Más pequeño, más elegante, más delgado. Pero con ese obstáculo despejado, ¿cuánto tiempo tardarán los nuevos Pods en llegar a los PWD? Insulet ha estado actualizando su sitio web regularmente y, a partir de ahora, el plazo parece ser a fines de febrero o antes de finales de marzo. Pero algunas personas han estado escuchando otras fechas, como algunos padres de niños con diabetes tipo D que dicen en foros que les han dicho que la bomba más nueva no estará disponible hasta abril.

Sistema de bomba de insulina Medtronic 530G (con sensor Enlite)
En junio de 2012, Medtronic presentó su sistema de bomba-CGM de próxima generación a la FDA para su evaluación.Lo que se conoce como la bomba Medtronic Veo en Europa (¡disponible desde 2009!), Esta bomba tiene la característica de baja suspensión de glucosa (LGS) que utiliza tecnología CGM para detectar el bajo nivel de azúcar en la sangre y suspender automáticamente la administración de insulina hasta dos horas si no responden a las alarmas. Este es el próximo paso hacia el páncreas artificial, y nuestra comunidad ha anticipado con entusiasmo la llegada de esta bomba más inteligente en los EE. UU.
Esa nueva bomba incluirá el sensor CGM de última generación, largamente esperado, llamado Enlite (disponible en el exterior desde 2011). Quienes hemos usado el sensor Medtronic CGM actual nos referimos a él como "el arpón", ya que utiliza una aguja larga que a menudo puede ser un poco dolorosa en la inyección, y luego flop y tira un poco durante el uso. Así que estamos mareados por este nuevo sensor Enlite
que supuestamente es menos doloroso, más preciso y tiene un tiempo de uso de seis días en lugar de tres.

Muchos en línea especulan que la FDA no aprobará uno sin el otro, específicamente dado que el sensor Enlite diseñado para una vida más larga no funcionará con las bombas de insulina actuales. En cambio, el Enlite necesitaría la bomba 530G para ser aprobada. En los foros de CWD y en las oficinas de los médicos de todo el mundo, Word dice que esto "llegará pronto". Al igual que a principios de 2013, todos esperamos …
Aún así, eso podría significar cualquier cosa.
Una reciente promoción de fin de año de Medtronic ayudó a alimentar ese mensaje. Conocida como la "Nueva garantía tecnológica", este programa alentó a las personas a comprar la bomba de insulina Paradigm Revel (523 o 723) más reciente entre el 15 de noviembre y el 31 de diciembre de 2012, con la garantía de una actualización gratuita al sistema de bombeo más nuevo antes de abril 13, 2013. ¿El problema con eso? Bueno, a partir de ahora, Revel IS es el modelo de bomba más reciente y más actual, por lo que compraría el modelo más nuevo con lo que básicamente es una garantía de actualización falsa. A MENOS QUE el 530G se apruebe antes de abril y Medtronic lo haya hecho disponible para cubrir esa garantía.
Hmmm … tal vez Medtronic sepa algo que todavía no nos han dicho. Entonces, preguntamos.Desafortunadamente, al igual que el resto de las compañías de dispositivos D, Medtronic no dice mucho oficialmente que signifique algo
.

Llevamos a cabo una variedad de promociones durante el año … Organizamos esta promoción de fin de año para ayudar a los pacientes a aprovechar los deducibles de fin de año o adicionales fondos dentro de su cuenta de ahorro de salud, sin temor a perder ninguna tecnología nueva (dado que nuestras bombas tienen garantías de 4 años). En cuanto al período de tiempo, cada promoción que tenemos debe tener una fecha de inicio y finalización. fecha al final del año por el motivo indicado anteriormente. La información relativa al número de clientes que participan en la promoción es confidencial. "
, al igual que los otros dispositivos D, solo el tiempo dirá si / cuando Medtronic obtiene la aprobación en 2013.
que el producto esté listo para producción aquí en los EE. UU. En la Cumbre de Roche Diabetes Social Media en En agosto, nos enteramos de que, a pesar de la aprobación de la FDA de la bomba Solo inicial, Roche no tenía previsto vender comercialmente el dispositivo inicial porque no tenía un monitor de azúcar en la sangre integrado o integración de CGM. Parece que sintieron que no sería capaz de competir contra las bombas de parche existentes (OmniPod!) Sin esas características.

También hicimos consultas en CellNovo Patch Pump y el adaptador de medidor de glucosa / teléfono inteligente Darío, pero ninguna de las compañías respondió. En cualquier caso, ambos están tratando de despegar en Europa, por lo que básicamente no esperamos verlos en Estados Unidos en 2013.
Una vez más, para tener una idea de lo que podría estar en el horizonte aquí en EE. UU., tendremos que estar atentos al mercado europeo este año.
Afortunadamente, veremos algún cambio rápido en la aprobación regulatoria y algunos de estos dispositivos D estarán listos para el uso de U. S. PWD en poco tiempo. Después de todo, son nuestros relojes (de salud) los que más ruido marcan.
Descargo de responsabilidad
: contenido creado por el equipo de Diabetes Mine. Para más detalles, haga clic aquí.
Descargo de responsabilidad Este contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.¡Nuevos comentarios en nuestra 'Cocina de prueba' para productos para la diabetes!

Test Cocina: los pacientes revisan los productos para la diabetes

DiabetesMine Test Kitchen es un nuevo centro para la revisión de videos de productos para la diabetes donde los pacientes utilizan reseñas de productos dirigidos en el cuidado de enfermedades crónicas.
El reloj marca los nuevos productos D para 2013





