Actividad física o ejercicio - ¿Cuál es mejor para vivir saludable?
Tabla de contenido:
- Afrezza Adrift, Among Insulin Wars
- All in One Meter … Finalmente
- CGM Pipeline: Dexcom & Medtronic
- Muchos observadores y expertos de la industria esperan que la nueva tecnología FreeStyle Libre Flash Glucose Monitoring (FGM) de Abbott llegue finalmente a EE. UU. En 2016 o poco después.Este sistema combina pruebas de punción digital y CGM existente (monitoreo continuo de glucosa) con un toque de tecnología no invasiva. Es decir, consiste en un pequeño sensor blanco redondo que se usa en la piel, y un "receptor" que se parece a un PDM de mano, que se mueve sobre el sensor para recoger lecturas de glucosa de forma inalámbrica.
- Además del líder del mercado Medtronic, ¿qué podemos esperar de los fabricantes de bombas de insulina en 2016?
- Como informamos en octubre, es probable que los pacientes tengan acceso a un nuevo conjunto de infusión de insulina muy mejorado en 2016, uno que elimina gran parte de la falta de fiabilidad de los conjuntos actuales.
- Para fin de año, es posible que podamos oler un glucagón en polvo por la nariz como una forma
- Este contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.
Es una tradición de Año Nuevo aquí en 'Mine mirar hacia adelante en los nuevos tratamientos y la tecnología

Hemos estado escuchando llamadas de ingresos y hablando con ejecutivos de empresas, expertos de la industria y equipos de relaciones públicas para tener una idea de qué más está en el horizonte para este nuevo año, compilado en el siguiente informe.
(En caso de que sienta curiosidad por nuestras predicciones anteriores de , puede echar un vistazo a nuestros informes para 2014 y 2015).
Afrezza Adrift, Among Insulin Wars
Afrezza: Tristemente, este año arrancó con las noticias de última hora del martes que Sanofi había prohibido su acuerdo con MannKind Co

No, la noticia no es que MannKind esté descontinuando Afrezza en este momento. Acaban de perder su respaldo del gigante farmacéutico Sanofi, por lo que todos los derechos y responsabilidades ahora vuelven por defecto a MannKind, que se queda con la cartera. MannKind asumirá la producción de Afrezza de Sanofi en los próximos tres a seis meses, según los informes. En un webinar de medio día el martes, el gerente de finanzas de MannKind, Matt Pfeffer, dijo que la compañía está explorando jugadas estratégicas sobre lo que hará a continuación, insinuando encontrar un nuevo socio. Aseguró a los usuarios que "no habrá interrupción en la terapia" y se mostró bastante optimista sobre las perspectivas de MannKind, afirmando que la separación con Sanofi "no es un revés sino una oportunidad para Afrezza".
Realmente esperamos que tenga razón, porque muchos Los PWD (incluido el editor de "Mine AmyT y mi propia madre que vive con T1D) han estado usando y amando a Afrezza este año pasado. Ahora, la Era Afrezza bien podría estar llegando a su fin intempestivo … ya veremos.
Mientras tanto, la incertidumbre en torno a la insulina inhalada sigue siendo solo una parte de las actuales Guerras de Insulina que continúan entre los tres grandes fabricantes, Eli Lilly, Novo Nordisk y Sanofi, que solo se intensificarán en 2016, ya que persiguen la insulina y otros medicamentos nuevos y competitivos para la diabetes.
Sanofi: Aparte de las noticias de Afrezza, la nueva insulina altamente concentrada U-300 de Sanofi Toujeo ("el Hijo de Lantus") llegó al mercado el año pasado, con cierta emoción y también un poco de confusión con la dosificación conversión. Ahora Sanofi está fijando su punto de vista de 2016 en los agonistas de GLP-1 y las drogas combinadas GLP-1 / insulina basal aquí en la U.S. En septiembre, presentaron una nueva aplicación de medicamentos de la FDA para Lyxumia (lixisenatida). Eso allana el camino para el fármaco combinado Lixilan (Lyxumia + Lantus) una vez aprobado.
Novo: La nueva insulina basal de larga duración Tresiba de la compañía de Nueva Jersey llegó al mercado en 2015 y ha estado enfrentada cara a cara contra Toujeo de Sanofi. Novo también está desarrollando una versión de acción más rápida de Novolog, que aún no tiene un nombre que no sea su apodo de ensayo clínico NN11218. Novo ha finalizado los estudios clínicos de Fase III de este medicamento y espera tenerlo listo para el mercado en algún momento de 2016.
Eli Lilly: A mediados de diciembre, la FDA aprobó su nueva insulina Basaglar basal, descrita como una versión menos costosa de Sanofi's Lantus, que ha estado dominando el mercado durante una década. Lilly ha declarado que Basaglar estará listo para el mercado a finales de 2016. Por supuesto, también tendrán que competir con Toujeo y Tresiba, así que ¡prepárate para guerras de marketing, usuarios de Insulin!
All in One Meter … Finalmente
Justo cuando estábamos riendo por otro año sin que esos elusivos medidores "todo en uno" salieran al mercado … ¡Bam! Unos días antes de Navidad, la FDA aprobó el medidor Darío fabricado por LabStyle Innovations con sede en Israel que ha estado bajo revisión regulatoria desde principios de 2014. Hemos cubierto el dispositivo anteriormente, y definitivamente no estábamos conteniendo la respiración debido a la tradicional reticencia de la FDA a aprobar este tipo de medidores Parece que las mareas han cambiado, y estamos ansiosos por ver a Darío en vivo en los Estados Unidos pronto en 2016.

Dario es un pequeño e inteligente medidor compacto que se conecta a la toma de teléfono de tu teléfono inteligente y, tan pronto como conectas el dispositivo, tu teléfono inteligente cambia al modo de monitoreo de glucosa en sangre. A continuación, haga clic en abrir el dispositivo de punción autónomo que contiene lancetas desechables y un cartucho integrado de 25 tiras de prueba patentadas, lo que le permite mover el dedo como cualquier otro medidor. La lectura que recibe se transmite directamente al teléfono inteligente a través de una aplicación que estará disponible de forma gratuita.
El portavoz Todd Durniak, vicepresidente ejecutivo y gerente general de la división U.S. de LabStyle Innovations, nos dice que Darío está en una vía rápida para prepararse para el lanzamiento; los acuerdos de distribución están siendo finalizados y serán anunciados pronto. Él dice que el costo será "competitivo y comparable" a otros sistemas de medidores. Dario será compatible primero con iPhone, y Android más tarde estará pendiente de la aprobación de la FDA para ese sistema operativo.
CGM Pipeline: Dexcom & Medtronic
Dexcom: Estamos a solo unos meses de haber pasado el tan esperado lanzamiento del G5 que elimina la necesidad de un receptor separado al ofrecer direct a la capacidad de un teléfono inteligente, pero pronto habrá más. El vicepresidente de Estrategia y Desarrollo Corporativo de Dexcom, Steven Pacelli, dice que las llamadas a resultados han contenido todas las pistas que la compañía puede revelar públicamente en este momento. De lo que podemos deducir, hay una buena cantidad de progreso en el horizonte para los próximos meses:
- Compatibilidad con Android para el G5, que hasta ahora sigue siendo solo para iPhones
- Se acerca más progreso en la integración de Apple Watch pronto, eso permitirá a los usuarios de G5 ver sus propios datos en Watch
- Se espera un nuevo dispositivo de inserción de un solo botón en algún momento a mediados de 2016.A partir de prototipos de imágenes que hemos visto, parece asemejarse al REPLACEador de sensores Medtronic Enlite que puede funcionar con un transmisor G5 de tamaño reducido
- , que será más compacto que el G5 actual e incluso más pequeño que el modelo G4 anterior
¿Más emocionante? Dexcom aún planea presentar su G6 de nueva generación en los próximos meses, lo que se espera sea un verdadero salto hacia adelante en tecnología CGM con 10 días de desgaste en lugar de los 7 actuales, solo se requiere una calibración en lugar de dos, y precisión y confiabilidad mejoradas.

Medtronic:
Es posible que los dispositivos nuevos de MedT no lleguen al mercado en los próximos 12 meses, pero es probable que sea un gran año de progreso en el desarrollo de tecnología de próxima generación y el intercambio de datos. Glooko agregará datos de Medtronic a su plataforma pronto, y se espera que el nuevo sistema Minimed Connect pronto sea compatible con Android.
La portavoz de Medtronic, Amanda Sheldon, dice que la compañía planea presentar su sistema Minimed 640G a principios de 2016. El dispositivo está disponible en el extranjero el año pasado y los ensayos clínicos se completan aquí en el U
. S., entonces aunque este dispositivo no se borre a tiempo para el lanzamiento de 2016, la presentación en sí misma es un importante paso adelante. El 640G tendrá un aspecto completamente nuevo, elegante y moderno, y un diseño vertical, en comparación con el diseño horizontal y el aspecto prolongado que han tenido estas bombas.
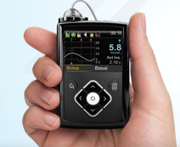
predecir hypos antes de tiempo y suspender la dosificación para prevenir realmente los mínimos, algo que el 530G actual no puede hacer hasta que cruce un umbral bajo. El 640G incorporará un sensor de cuarta generación, el Enlite 3, la próxima generación más allá de lo que actualmente está disponible en Europa, conocido como Enlite 2 o Enhanced Enlite. Sheldon dice que los estudios clínicos 640G se realizaron a partir de los 14 años de edad, por lo que tendrán al menos más aprobación pediátrica de lo que MedT normalmente tenía con su tecnología más nueva.
Preguntamos acerca de la designación pediátrica para la combinación actual de bomba-CGM de Minimed 530G aprobada en septiembre de 2013, pero MedT todavía no la recibió a través de la FDA y no tiene una línea de tiempo planificada. Decepcionante para escuchar, ya que obliga a los jóvenes a esperar el 640G.
En el futuro, comprendemos que Minimed 670G será un sistema híbrido de ciclo cerrado que Medtronic espera estudiar desde el primer momento en todos los grupos de edad. Esa tecnología futura se proyecta en algún momento en 2017-18.
Abbott Freestyle Libre
Muchos observadores y expertos de la industria esperan que la nueva tecnología FreeStyle Libre Flash Glucose Monitoring (FGM) de Abbott llegue finalmente a EE. UU. En 2016 o poco después.Este sistema combina pruebas de punción digital y CGM existente (monitoreo continuo de glucosa) con un toque de tecnología no invasiva. Es decir, consiste en un pequeño sensor blanco redondo que se usa en la piel, y un "receptor" que se parece a un PDM de mano, que se mueve sobre el sensor para recoger lecturas de glucosa de forma inalámbrica.
Puede hacer esto tanto o tan poco como desee, lo que lo convierte en una forma potencial de eliminar la necesidad de utilizar costosas tiras de prueba sin comprometerse con un dispositivo CGM completo si lo desea.
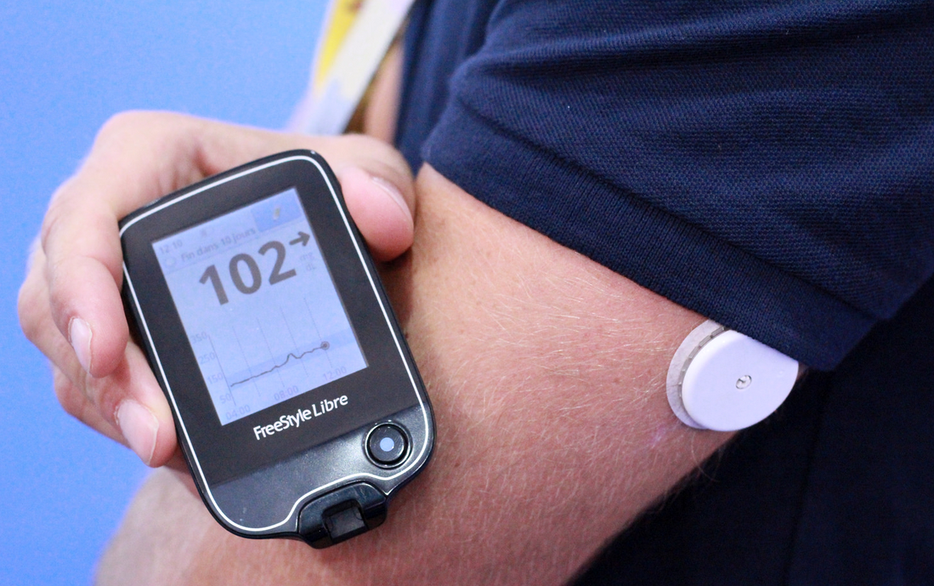
El Libre ha estado disponible en el extranjero durante el año pasado, y está obteniendo comentarios en su mayoría positivos. Si bien Abbott no hará comentarios específicos sobre un cronograma para EE. UU., Confirma los planes para llevarlo a Estados Unidos en base a la versión Pro que ya se presentó a la FDA. También hay un estudio fundamental que se completó el año pasado para la versión Personal, y una agencia de relaciones públicas para Abbott nos dice que la compañía "ha tenido discusiones positivas con la FDA y que la aprobación del plan para otro ensayo clínico nuevo" lo alienta ".
En Europa también lanzaron recientemente LibreLink, una aplicación móvil que permite a los usuarios de FreeStyle Libre acceder directamente a los datos de glucosa en sus teléfonos inteligentes. Desarrollada por AirStrip, la aplicación LibreLink es la única aplicación aprobada y certificada para su uso con el sensor FreeStyle Libre.
Aunque todavía no podemos olvidar el hecho de que Abbott suspendió el CGM FreeStyle Navigator aquí en los Estados Unidos hace años de una manera tan descuidada, estamos entusiasmados con la apertura de Libre que ofrece un nuevo tipo de herramienta para PWD. Esperamos ver un progreso significativo para el final del año.
Progreso de la bomba de insulina
Además del líder del mercado Medtronic, ¿qué podemos esperar de los fabricantes de bombas de insulina en 2016?

Esta empresa no estaba al tanto de sus planes para el próximo año, por lo que nos quedamos con lo que ya sabemos esperar para 2016: actualizaciones sobre Project Odyssey, el nuevo proceso de actualización de productos que Tandem planea para archivar con el FDA. El objetivo es poder proporcionar actualizaciones de productos de forma remota, al igual que lo haría con una nueva actualización del sistema de teléfono inteligente. Para que esto suceda, necesitan que la FDA les dé luz verde para activar el Bluetooth en las bombas t: slim existentes para que los usuarios puedan comenzar a actualizar las características sin la necesidad de comprar hardware completamente nuevo, e incluso a la posible "conexión" de la integración con el nuevo Dexcom G5 habilitado para Bluetooth, aprobado recientemente a fines de 2015.
Insulet / OmniPod
El director de marketing Christopher Gilbert nos dice que están dirigidos a enviar su siguiente PDM prod
uct a la FDA en el medio de 2016. "También estamos buscando opciones de integración para el sensor G5 con el dispositivo OmniPod. Nuestra investigación de mercado demuestra que los pacientes realmente quieren ver esta información idealmente en su teléfono junto con información adicional de OmniPod. Y así (junto con Dexcom ) están evaluando formas de acelerar la integración de CGM … "

También vale la pena señalar que el desarrollo continuo de Insulet funciona con Eli Lilly en un OmniPod U-500 que utilizará una insulina de mayor concentración para aquellos que necesitan más unidades por día. En las últimas polillas, un ensayo clínico comenzó con pacientes tipo 2 que se extenderá hasta diciembre de 2016. Así que aunque no veremos un lanzamiento este año calendario, esperamos que la ciencia termine este año y pueda llegar a mercado en 2017.
JnJ / Lifescan / AnimasLa gran novedad del año pasado fue el dispositivo combinado bomba-CGM Animas Vibe finalmente llegando al mercado después de muchos años de espera, y por supuesto nos preguntamos si tenían alguna actualización , como el lanzamiento de herramientas de intercambio de datos o la integración de la próxima generación con el G5, como lo está haciendo Tandem.
El director de comunicaciones de Lifescan Dave Detmers dice que nuestra D-Community puede mirar dos cosas específicas este año:
- Están a la espera de la aprobación de la FDA de la indicación pediátrica para Animas Vibe. Aunque los médicos han prescrito esto a los niños fuera de la etiqueta, eso no ha sido aprobado por la FDA y oficialmente solo ha sido una opción para los adultos. OneTouch Verio Flex Meter
- : Espere un lanzamiento del producto en la primera mitad de 2016 para este medidor que ya está disponible en Canadá y Europa. Verio Flex es un nuevo medidor conectado por Bluetooth que tiene un diseño blanco delgado, números grandes fáciles de leer y un indicador de rango de tres colores para reconocer fácilmente si su resultado de BG es Bajo, Alto o Dentro de Rango.

Conjunto de infusión BD Flowsmart

Como informamos en octubre, es probable que los pacientes tengan acceso a un nuevo conjunto de infusión de insulina muy mejorado en 2016, uno que elimina gran parte de la falta de fiabilidad de los conjuntos actuales.

Existen más de 20 tipos de conjuntos de infusión en el mercado, pero el hecho es que los errores de oclusión son desenfrenados.Flowsmart tiene como objetivo reducir estos errores con un segundo puerto lateral que permite un camino alternativo para la insulina, más una conexión de tubería giratoria y un tipo especial de tecnología de infusión de baja presión para ayudar a reducir los bloqueos. También ofrece el catéter más pequeño en el mercado.
Glucagón en la nariz
Para fin de año, es posible que podamos oler un glucagón en polvo por la nariz como una forma
mejor de aumentar el azúcar en la sangre rápidamente en casos de emergencia.

Locemia está diseñada como un vial de Flonase que se REPLACEa en una fosa nasal, y luego simplemente presiona un botón y olfatea el polvo, ¡y en unos minutos ya está funcionando! Hemos cubierto Locemia extensamente aquí en '
Mine , incluida mi propia experiencia en ensayos clínicos al usarla en 2014. Originalmente, Locemia había hablado acerca de cómo presentarla ante la FDA a mediados de 2016, entonces tenemos asumir que Lilly seguirá esa misma línea de tiempo, especialmente cuando los ensayos de Fase III están terminando. La portavoz de Lilly, Julie Williams, nos dice: "Estamos trabajando arduamente para garantizar que los nuevos envíos de aplicaciones de medicamentos estén respaldados por un paquete clínico robusto y una estrategia de cadena de suministro confiable. Una vez que estos elementos estén en vigencia, esperamos realizar presentaciones reglamentarias". ¡Bien!
Sin duda, está sucediendo mucho más para 2016 en el lado de la investigación, y en el intercambio de datos y la tecnología de circuito cerrado, etc. Además, el mundo en constante expansión de la salud móvil nos va a traer más emoción durante 2016, sin dudas.
Lo que se menciona arriba es algo con lo que podemos contar en el mundo de los productos.
Así que cuéntanos, Diabetes Friends: ¿Qué tienes en los ojos para 2016?
Descargo de responsabilidad
: contenido creado por el equipo de Diabetes Mine. Para más detalles, haga clic aquí. Descargo de responsabilidadEste contenido está creado para Diabetes Mine, un blog de salud del consumidor enfocado en la comunidad de la diabetes. El contenido no se revisa médicamente y no cumple con las pautas editoriales de Healthline. Para obtener más información sobre la asociación de Healthline con Diabetes Mine, haga clic aquí.
DiabetesMine visita la AADE Expo 2014 para presentarle todas las novedades

DiabetesMine visita la AADE Expo 2014 para brindarle todas las novedades sobre los productos más nuevos disponible para personas con diabetes. Obtenga la verdad de DiabetesMine.
Novedades en productos para la diabetes: sugerencias para lectores

Novedades de la tecnología de la diabetes para 2017 | DiabetesMine

DiabetesMine informa qué esperar de las nuevas herramientas y tecnología para la diabetes cuando comenzamos el nuevo año.


